Kimyasal Yapıdan Atmosferdeki Rolü Oksijen ve Allotroplar
Oksijen, periyodik tabloda ikinci periyotta ve on altıncı grupta yer alan, kimyasal sembolü O olan ve atom numarası 8 olarak tanımlanan temel bir kimyasal elementtir. Ametal özellik gösteren oksijen, evrende kütle bakımından hidrojen ve helyumdan sonra en bol bulunan üçüncü elementtir. Dünya kabuğunda en yüksek oranda bulunan element olmasının yanı sıra, insan vücudunda da kütle bakımından en fazla yer kaplayan elementtir. İsmini Yunanca asit anlamına gelen oxys ve oluşum anlamına gelen genes kelimelerinden alır. Oksijen ilk kez 1772 yılında Carl Wilhelm Scheele tarafından, bağımsız olarak ise 1774 yılında Joseph Priestley tarafından keşfedilmiş, elemente bugünkü adını ise Antoine Lavoisier vermiştir.
Allotropi Kavramı ve Oksijen
Allotropi, bir elementin atomlarının farklı bağlanma biçimleriyle birden fazla yapısal formda bulunabilmesi özelliğini ifade eder. Karbon, fosfor, kükürt ve oksijen gibi bazı elementler bu özelliği gösterir. Her allotrop, aynı elementten oluşmasına rağmen farklı fiziksel ve kimyasal özelliklere sahiptir. Oksijenin en bilinen allotropları dioksijen ve ozondur. Bu iki form hem yapısal hem de işlevsel açıdan birbirinden oldukça farklıdır.
Dioksijenin Yapısı ve Özellikleri
Dioksijen, kimyasal formülü O2 olan ve doğada en yaygın bulunan oksijen allotropudur. Atmosferde azot ile birlikte havanın ana bileşenlerinden biridir ve hacimsel olarak yaklaşık yüzde yirmi bir oranında bulunur. Renksiz, kokusuz ve tatsız bir gaz olan dioksijen, iki oksijen atomunun çift bağ ile bağlanmasıyla oluşur. Moleküler ağırlığı otuz iki gramdır ve suda sınırlı miktarda çözünür.
Dünya’nın erken dönemlerinde atmosferde serbest oksijen neredeyse yokken, fotosentetik organizmaların gelişmesiyle birlikte dioksijen miktarı artmıştır. Günümüzde bitkiler, algler ve siyanobakteriler fotosentez yoluyla oksijen üretirken, bu oksijen aerobik canlıların solunumunda hayati bir rol oynar. Oksijen, enerji üretimi için şekerlerin ve diğer organik bileşiklerin oksidasyonunda temel bir bileşendir. Yanmayı desteklemesi ve güçlü bir oksitleyici olması nedeniyle endüstride, tıpta ve kaynak işlemlerinde yaygın olarak kullanılır.
Ozonun Yapısı ve Fiziksel Özellikleri
Ozon, üç oksijen atomundan oluşan ve O3 formülüyle ifade edilen daha az kararlı bir oksijen allotropudur. Kendine özgü keskin bir kokuya sahip olan ozon, yüksek konsantrasyonlarda toksiktir. İlk kez 1840 yılında Christian Friedrich Schönbein tarafından tanımlanmış ve adını Yunanca koku anlamına gelen ozein kelimesinden almıştır.
Ozon, oksijene kıyasla çok daha güçlü bir oksitleyicidir ve bu nedenle biyolojik dokulara ve bazı malzemelere zarar verebilir. Düşük sıcaklıklarda sıvı ve katı hale geçebilir ve bu hallerde mavi tonlarında bir renge sahiptir. Ozon, atmosferde kararsızdır ve kısa süre içinde tekrar dioksijene dönüşür.
Troposferik Ozon ve Çevresel Etkileri
Troposfer, atmosferin yer yüzeyine en yakın katmanıdır. Bu bölgede bulunan ozon, kirletici olarak kabul edilir. Araç egzozları ve endüstriyel faaliyetler sonucu ortaya çıkan azot oksitler ve hidrokarbonların güneş ışığıyla tepkimeye girmesi sonucu oluşur. Troposferik ozon, solunum yollarında tahrişe, baş ağrısına ve göz yanmasına neden olabilir. Uzun süreli maruziyet, özellikle astım hastaları için ciddi sağlık sorunlarına yol açabilir.
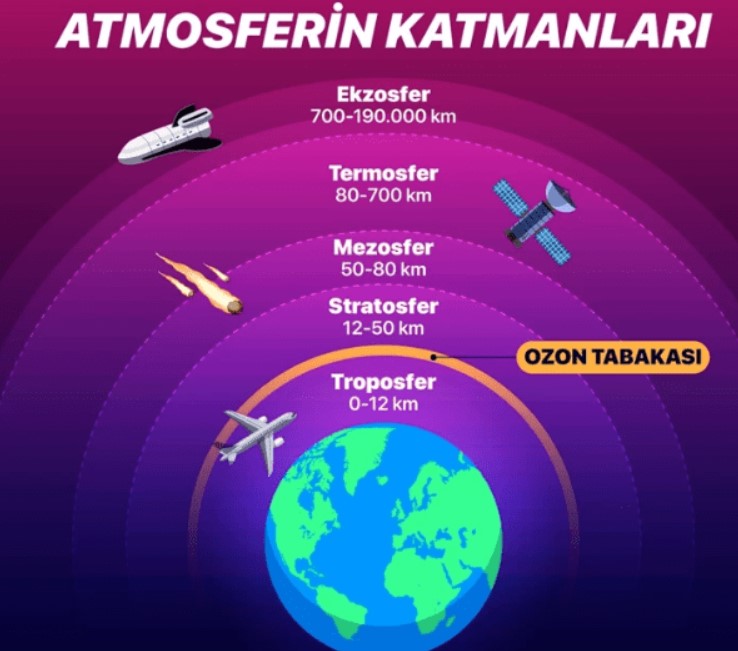
Aynı zamanda bitkiler üzerinde de olumsuz etkileri bulunan bu ozon türü, fotosentezi baskılayarak tarımsal verimi düşürebilir. Bu nedenle Dünya Sağlık Örgütü tarafından hava kalitesi standartları kapsamında sıkı şekilde izlenmektedir.
Stratosferik Ozon ve Ozon Tabakası
Stratosfer, troposferin üzerinde yer alan ve yerden yaklaşık elli kilometre yüksekliğe kadar uzanan atmosfer katmanıdır. Bu bölgede yoğunlaşan ozon, ozon tabakası olarak bilinir. Stratosferik ozon, Güneş’ten gelen zararlı ultraviyole ışınlarını emerek yeryüzüne ulaşmalarını engeller ve böylece canlı yaşamını korur.
Ozon tabakasındaki incelme, özellikle klor ve brom içeren kimyasal bileşiklerin atmosfere salınmasıyla ilişkilidir. Bu durum, daha fazla UV ışınının yeryüzüne ulaşmasına ve cilt kanseri gibi sağlık sorunlarının artmasına neden olabilir.
Ozonun Sağlıkla İlişkisi
Ozon, bağışıklık sistemi tarafından bazı mikroorganizmaları etkisiz hale getirmek amacıyla sınırlı miktarda üretilebilir. Ancak güçlü oksitleyici özellikleri nedeniyle hücresel yapılara zarar verme potansiyeline de sahiptir. Ozonun, iltihaplanma süreçlerine katkıda bulunabileceği ve damar sertliğiyle ilişkili olabileceği düşünülmektedir. Buna rağmen, ozonun vücut içindeki etkileri hâlâ bilimsel olarak tam anlamıyla netlik kazanmamıştır.
Ozon Tedavisi Tartışmaları
Ozon tedavisi, bazı ülkelerde alternatif tıp uygulamaları arasında yer alsa da, bilimsel geçerliliği tartışmalıdır. Amerika Birleşik Devletleri Gıda ve İlaç Dairesi, ozonun toksik etkileri ve kanıtlanmış bir tedavi edici yararı bulunmaması nedeniyle tıbbi amaçla pazarlanmasını yasaklamıştır. Buna rağmen, bazı bireyler ozon tedavisini kendi inisiyatifleriyle kullanmaya devam etmektedir.
Ozonun Endüstriyel Kullanım Alanları
Ozon, endüstride özellikle su arıtma ve dezenfeksiyon işlemlerinde kullanılır. İçme suyu arıtma tesislerinde bakterileri ve parazitleri yok etmek amacıyla klora alternatif olarak tercih edilir. Ayrıca ameliyathanelerin sterilizasyonunda, koku gideriminde ve bazı kimyasal sentez süreçlerinde önemli bir rol oynar. Yüksek oksidasyon gücü sayesinde çevreye kalıcı yan ürünler bırakmaz.
Oksijenin Diğer Allotropik Formları
Dioksijen ve ozon dışında oksijenin atomik oksijen, tekli oksijen, tetraoksijen ve katı oksijen gibi daha nadir allotropları da bulunmaktadır. Bu formlar genellikle yüksek enerji, yüksek basınç veya özel koşullar altında oluşur. Özellikle katı oksijenin farklı fazları, manyetik ve elektriksel özellikleri nedeniyle bilimsel araştırmalar açısından büyük önem taşır.
Genel Değerlendirme
Oksijen, hem kimyasal çeşitliliği hem de biyolojik ve çevresel önemi açısından benzersiz bir elementtir. Dioksijen yaşam için vazgeçilmez bir bileşenken, ozon doğru yerde ve doğru miktarda bulunduğunda koruyucu, yanlış yerde ve yüksek yoğunlukta bulunduğunda ise zararlı bir maddeye dönüşür. Bu özellikleriyle oksijen, doğanın hassas dengesini ve kimyanın yaşamla olan güçlü bağını en iyi yansıtan elementlerden biridir.




